新闻
综述—外泌体提取方法的研究进展
外泌体是直径为30-150 nm的小细胞外囊泡。多年以来,外泌体被认为是细胞成熟过程中产生的“垃圾”。然而,随着最近从不同类型的外泌体中分离出各种蛋白质,脂质和遗传物质(例如,miRNA,mRNA,DNA分子以及lncRNA),它们在细胞通讯和表观遗传调控中的关键作用已经显现。在生理和病理条件下,几乎所有类型的细胞都可以释放外泌体,这些外泌体通过转运关键蛋白和遗传物质(例如miRNA,mRNA和DNA)在细胞通讯和表观遗传调控中发挥重要作用。
虽然外泌体有诸多开发潜力,但基于外泌体的临床应用依然发展缓慢。其中,有两个主要的技术障碍限制了外泌体的基础和应用研究。首先是外泌体的提取的标准化及外泌体的产率,二是如何有效区分外泌体从其他细胞外囊泡,特别是功能性囊泡。总之,外泌体的提取问题仍然是未来外泌体临床应用发展的关键。
近期,Dongbin Yang 团队在Theranostics(影响因子:8.579)上发表的一篇综述,通过全面分析现有的外泌体分离技术,为未来的外泌体分离方法及相关应用提供建议和见解。

1. 差速超速离心法
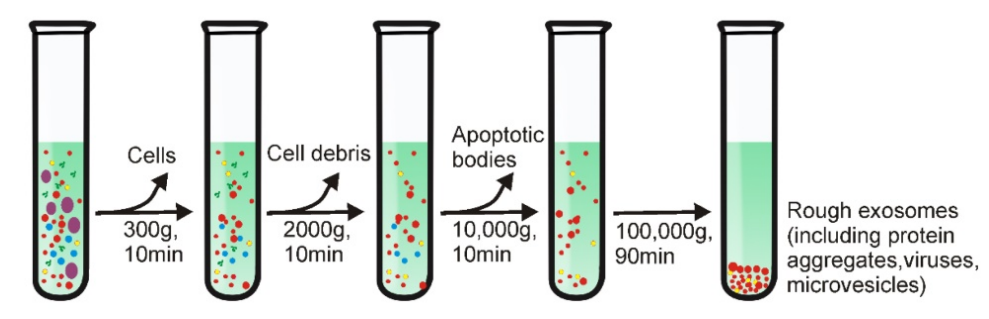
①差速超速离心法 超速离心是分离细菌、病毒、细胞器等小颗粒的最佳工艺,因此,超离心法很容易转化为外泌体分离。超速离心是利用离心力从300g到100,000g的多个离心循环来实现的,每离心一步后,除去细胞、细胞碎片、凋亡小体等杂质,最后获得较纯的外泌体。目前,超速离心仍被称为外泌体分离方法的“金标准”。
但是,“金标准”也并不是十全十美,细胞外囊泡具有高度的异质性,在一定的离心力下,所有具有密度、大小和质量达到一定阈值的组分(包括外泌体、微泡、蛋白质和脂蛋白等)均可在管底部析出。
优点:低成本,纯度高,适合制备较大体积样本。
缺点:设备要求高,耗时,高强度的离心力可能对外泌体造成机械损伤,容易造成脂蛋白等聚集。
②梯度超速离心法
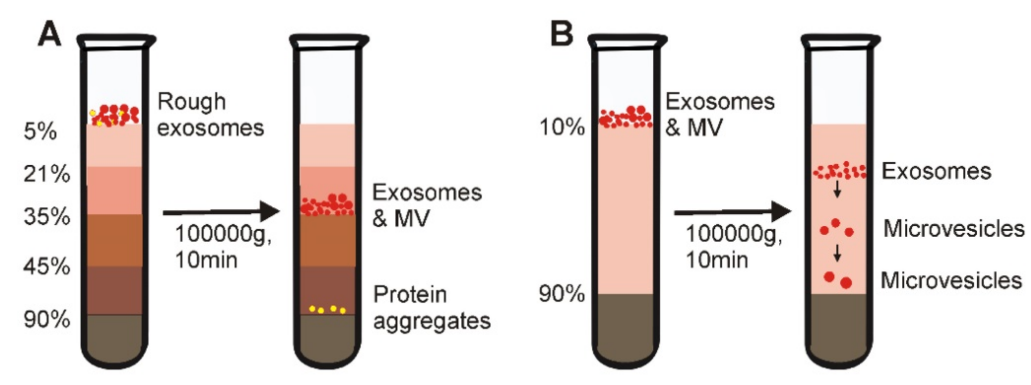
A)密度梯度超离心法是通过在从底部到顶部逐渐降低的层中添加介质(蔗糖或碘克沙醇)来制备的。长时间离心后,细胞外成分包括外泌体、凋亡小体和蛋白聚集物在密度相近的培养基中达到静止位置。
但是,由于等密度梯度超离心仅依赖于样品中不同溶质之间的密度差,所以该方法不能分离与外泌体具有类似密度的物质(如微泡)。
(B)移动梯度超离心法通常包括两个梯度介质段。最上层是密度低于样品所有溶质的介质。底部是高密度的垫子。由于溶质的密度都大于梯度介质的密度,离心后,不仅根据密度,还可根据质量/大小,将所有溶质依次分离,从而可以分离密度相似但大小不一的囊泡。
优点:获得的外泌体纯度高。
缺点:样本处理量低,设备要求高,耗时,高强度的离心力可能对外泌体造成机械损伤。
③超滤法
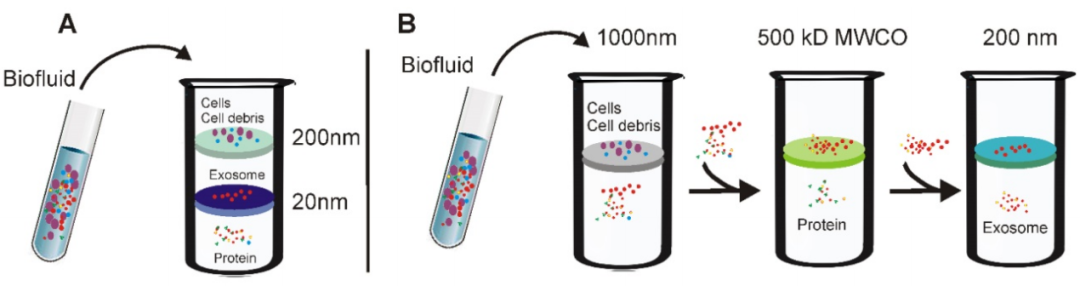
(A)微型串联超滤器:样本通过串联配置的微滤器,其尺寸排阻极限在20-200nm左右。当穿过两个膜时,包括细胞碎片,凋亡小体和大部分微囊的大囊泡被捕获在200nm膜中,而直径20至200nm的囊泡则保留在下部20nm滤膜上。
(B)连续超滤器:首先将细胞外液通过1000纳米过滤器以除去较大的颗粒(例如细胞或细胞碎片);然后将滤液通过截留值为500kD的第二个过滤器,以除去小颗粒,例如游离蛋白。最后,通过200nm滤光片收集<200nm的外泌体。
优点:设备成本低,方便快捷。
缺点:垂直的剪切力可引起膜的堵塞。
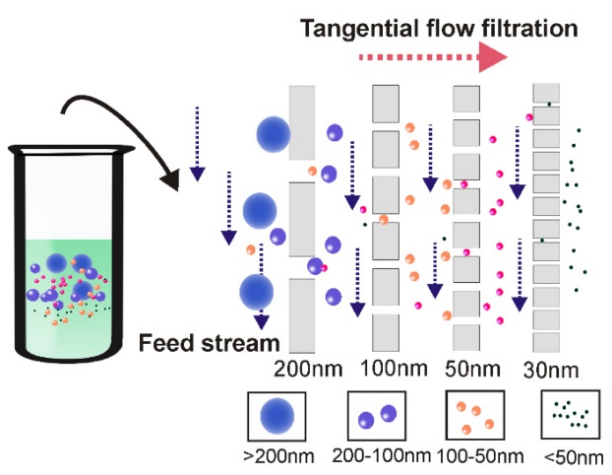
④切向流过滤法
在切向流过滤期间,进料流平行于膜面流动。所施加的压力使一部分液流根据过滤器的尺寸通过膜。由于膜始终在平行流动力的作用下,可以有效地减少潜在的堵塞。在切向流过滤过程中,将剩余部分重新循环回给料池以进行重复过滤,以确保彻底过滤。
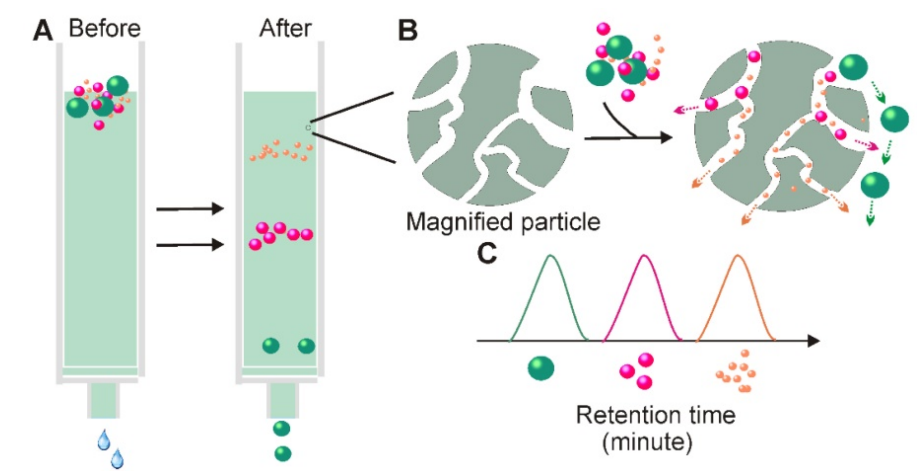
⑤分子排阻色谱法
当溶液通过由多孔树脂颗粒组成的固定相时,分子可以根据尺寸的大小进行分离(A)。小于固定相孔的颗粒进入孔中以获取更长的传输距离,而无法进入孔的较大颗粒直接在树脂(B)周围移动。这导致具有不同尺寸大小的颗粒表现出不同的保留时间,因此,此方法可使外泌体与其他不同大小的颗粒分离。
优点:外泌体纯度高,方便快捷,能保持外泌体的自然状态,重复性好,可用于大量样本的提取制备。
缺点:设备成本相对较高,纯化后的外泌体被严重稀释,所以需要额外的外泌体富集方法。
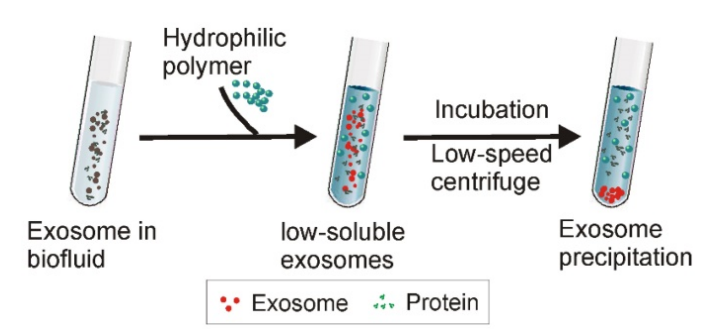
⑥聚合物沉淀法
在将高亲水性聚合物添加到含外泌体的溶液中后,外泌体周围的水分子被聚合物束缚,降低了外泌体的溶解度并诱导其随后的沉淀。使外泌体在低速离心下可以很容易沉淀。
优点:使用方便,不需要大型设备,适用于小样本和大样本,提取效率高。
缺点:蛋白质聚集物等杂质污染外泌体,需要进一步的纯化。
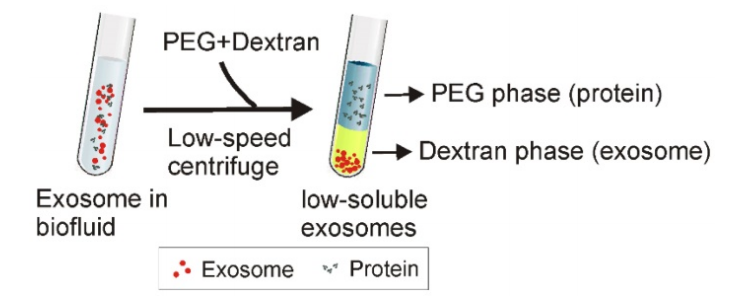
⑦两相法
当将疏水性更高的聚乙二醇(PEG)和亲水性更高的葡聚糖溶液混合时,可能会发生两相系统。将PEG和右旋糖酐添加到含外泌体的溶液中,然后进行孵育和低速离心后,蛋白质和其他大分子复合物优先聚集在PEG中,而外泌体优先聚集在右旋糖酐相中。
尽管高浓度的葡聚糖对外泌体造成一定的影响,但该方法提供了一种有潜力、廉价和快速的外泌体提取方法,可用于外泌体的粗分离。
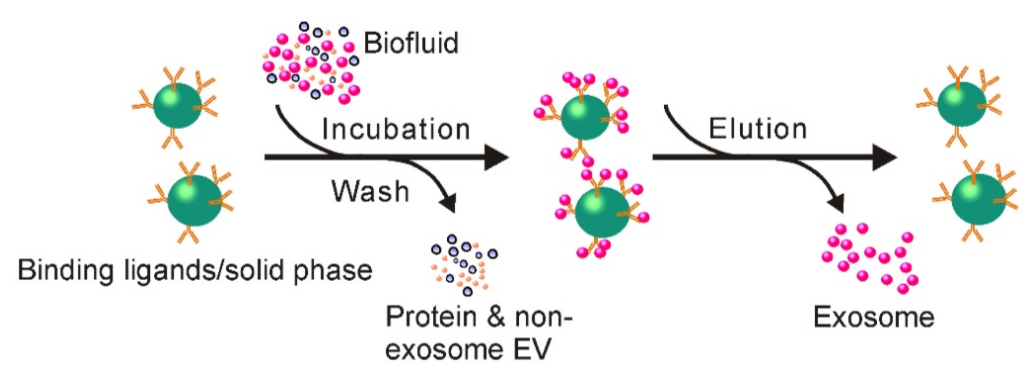
⑧免疫亲合法
将识别外泌体膜表面特异性标志物(CD9\CD63\CD81等)的抗体固定在固体基质上。用抗体偶联的固体基质孵育含外泌体的液体后,可将外泌体富集到此类固体基质上。可以通过洗脱步骤收集游离的外泌体。
优点:适合分离特定来源的外泌体,高纯液,使用方便,无化学污染。
缺点:高成本,样本处理量低,外泌体洗脱步骤可能会破坏原有的外泌体结构。
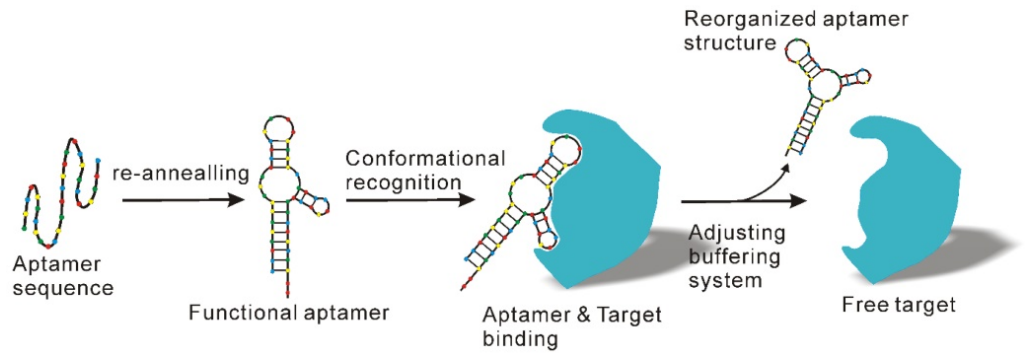
⑨适配体亲合法
尽管抗体产品具有独特的优势,抗体开发和生产相关的高成本极大的影响了其应用,特别是大规模的外泌体制备。
适配体是一种短链DNA或RNA序列,可以像抗体一样特异的识别并结合目标物,具有很高的亲和力和特异性。适配体通过构象互补识别并结合外泌体膜表面的靶标,在调整了缓冲系统的关键因素(如盐类型和离子强度)之后,适配体还可以发生形状变化并释放结合的外泌体。
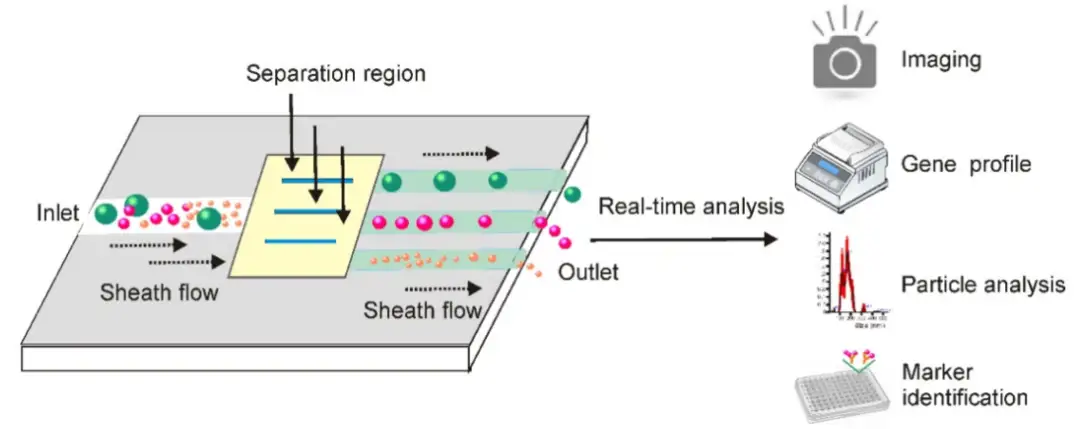
⑩集成微流控法
在将含有外泌体的液体添加到鞘层介质中之后,可以基于细胞外囊泡的物理和生化特性通过不同的方法分离。重要的是,在信号检测平台的帮助下,这些小型化的微流控设备不仅实现了从少量体液中快速分离外泌体,而且还可以进行实时外泌体表征以进行原位诊断。
优点:方便快捷,提取效率高,易于自动化和集成化。
缺点:样本处理量低。
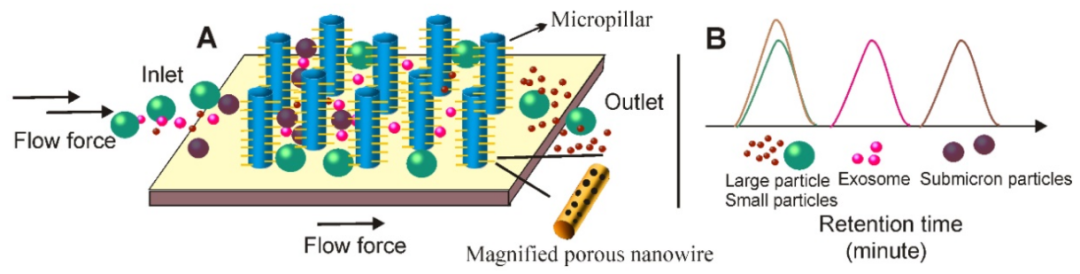
⑾纳米线分离法
(A)与基于SEC的分离类似,可以通过在均匀分离的微柱壁上压印含多孔硅的纳米线,创建微柱上的纳米线结构。在将含外泌体的液体添加到微柱上的纳米线分层结构后,液体中的颗粒会经历不同的命运;(1)直接从亚微米微柱阵列中排除较大的颗粒(例如细胞);(2)具有亚微米尺寸(例如,细胞碎片)的颗粒能够进入微柱区域,但无法进入30-200 nm纳米线区域;(3)小分子(例如蛋白质)在纳米线间隔内移动而不受阻碍;(4) 30–200 nm的粒子(例如外泌体)被纳米线森林所阻挡。(B)具有不同尺寸的颗粒呈现不同的保留时间,因此有利于尺寸依赖性分离。
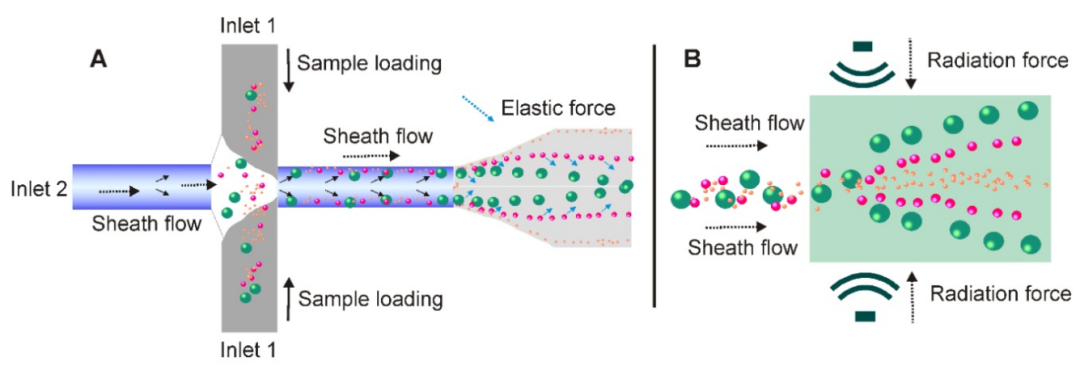
⑿非接触式微流控法
(A)在基于粘弹性介质流的微流系统中,含囊泡的流体(从inlet 1添加)遇到鞘流(从inlet 2添加),并首先沿微通道壁对齐。在施加由流体的粘弹性产生的弹性提升力后,外泌体和其他细胞外成分会根据其大小被驱向微通道的中心线,较大的颗粒最终会到达中心线。(B)在超声波的压力下,具有不同机械性能(例如,可压缩性,尺寸和密度)的颗粒经受不同的辐射力,并导致连续地无接触且依赖尺寸大小的外泌体分离。
外泌体纯化试剂盒SuperEV
分子排阻法和亲和色谱法的绝妙组合
双原理提取
获得更高纯度的外泌体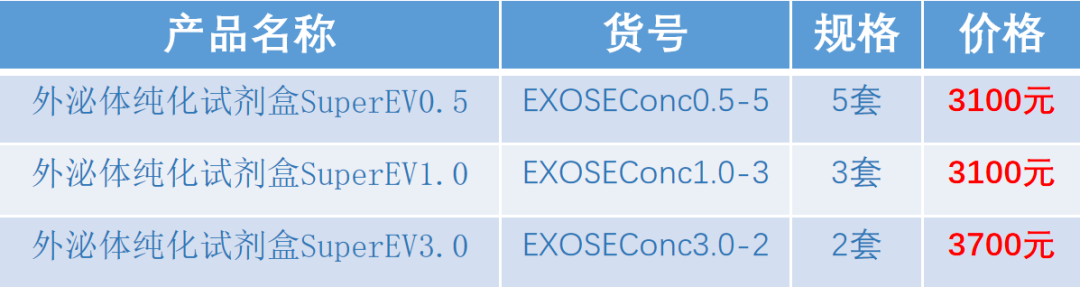
针对外泌体提取做了大量的研究,根据客户的不同需求,开发了多种外泌体提取试剂盒。
外泌体提取试剂盒(沉淀法)
外泌体浓缩试剂盒(亲和色谱法)
外泌体提取和纯化试剂盒(亲和色谱法)
细菌膜囊泡提取试剂盒(亲和色谱法)
SuperEV超纯尺寸排阻色谱柱(分子排阻)
外泌体纯化试剂盒SuperEV(SEC+Conc)
人外泌体捕获和分离酶标板(免疫酶标板)
外泌体捕获和分离试剂盒(免疫磁珠)⑤三梯度超速离心法